Zooplâncton
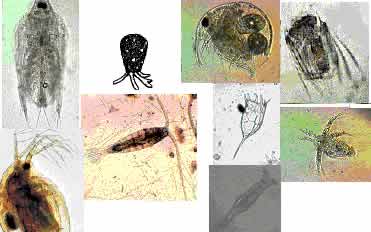
Lagos e reservatórios, independente de seu tamanho, assim como os grandes rios, são habitados por inúmeros organismos planctônicos. Esses organismos estão na base da cadeia alimentar e, graças a seu elevado metabolismo, são capazes de influenciar processos ecológicos fundamentais, como ciclagem de nutrientes e magnitude da produção biológica. O zooplâncton é constituído de consumidores primários (herbívoros) e predadores de diferentes níveis tróficos.
Ao contrário dos ambientes marinhos, o zooplâncton dos lagos e reservatórios, é composto de poucos
grupos de invertebrados aquáticos. São animais microscópicos, ou muito pequenos, podendo
atingir, em poucos casos, alguns milímetros, que nadam na zona de água aberta dos lagos e reservatórios.
Os principais componentes dessa comunidade são, por ordem de tamanho:
- protozoários: amebas, flagelados, ciliados;
- vermes asquelmintos: rotíferos;
- crustáceos: copépodes e cladóceros;
- insetos: larvas de moscas e de mosquitos; e
- etc.
Os ciliados, se alimentam de bactérias e algas; a maioria dos microcrustáceos (cladóceros) se alimentam do fitoplâncton, ou são omnívoros (copépodes); os peixes se alimentam do zooplâncton. Assim, o zooplâncton serve para melhorar a qualidade da água, já que controla o desenvolvimento do fitoplâncton através de sua alimentação seletiva.
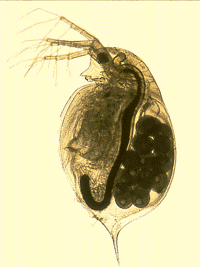
Alguns representantes do Zooplâncton, como a Daphnia sp., são usados como bioindicadores da degradação ambiental. O zooplâncton pode afetar diretamente a composição e a quantidade de fitoplâncton. A composição das espécies e o tamanho atingido pelo zooplâncton são ditados pelos peixes que dele se alimentam, originando um fator indicativo do aspecto, a longo prazo, da biologia do manancial. O zooplâncton pode ser regulado artificialmente. O tamanho e a estrutura do zooplâncton são uma importante variável da qualidade da água.
Coleta de Zooplâncton
Como os organismos zooplanctônicos vivem dispersos na coluna d´água, sua coleta, quase sempre,
envolve concentração prévia por meio de algum tipo de
filtragem. Podem ser usados os seguintes métodos:
- redes de plâncton
- planctonômetro (rede acoplada a tubo metálico)
- garrafas e tubos amostradores
- bombas de sucção e
- armadilhas de plâncton (caixas de metal ou acrílico).

A preservação do zooplâncton coletado pode ser realizada pela adição de agentes químicos (formalina com corante ou solução aquosa de formol a 4%, p.ex.) ou por meio de diferentes processos físicos (congelamento com posterior liofilização, p.ex.), sem necessidade de aditivos químicos.
Na foto ao lado, vemos uma rede de coleta de zooplâncton. Na parte superior, destaca-se o redutor cônico (que, em alguns modelos, pode ser metálico) e, na extremidade inferior, o copo coletor dotado de gaze para filtragem e saída dos organismos.

A foto seguinte mostra uma armadilha de Schindler usada para a coleta de Zooplâncton. Apresenta como vantagens sobre os outros dispositivos de coleta: a precisão do volume filtrado (17 litros, p.ex.) e o modo de fechamento do equipamento. A caixa é de acrílico, em que as dimensões verticais superam, pelo menos três vezes, as laterais, de modo a minorar o efeito do mecanismo de fechamento (oblíquo).
As seguintes técnicas de coleta de zooplâncton são recomendadas na literatura limnológica:
| Local | Microzooplâncton (< 200 um) | Mesozooplâncton ( > 200 um) |
|---|---|---|
| Águas abertas e prof.>3m | Garrafas, tubos ou bombas | Armadilhas, redes ou planctonômetros |
| Lagos rasos (prof.<3m) | Garrafas, tubos ou bombas | Armadilhas, tubos ou redes |
| Lagos c/ veg.ou zona litorânea | Garrafas, tubos ou bombas | Garrafas, tubos ou redes |
| Rios de grande porte | Garrafas ou bombas | Garrafas ou redes |
Contagem de Zooplâncton
A contagem do zooplâncton envolve grande multiplicidade de técnicas. Entretanto, destacam-se basicamente dois métodos: a contagem em microscópio (se seu tamanho for <2 um) e a cubeta de Sedgwick-Rafter (se o tamanho for > 20 um).
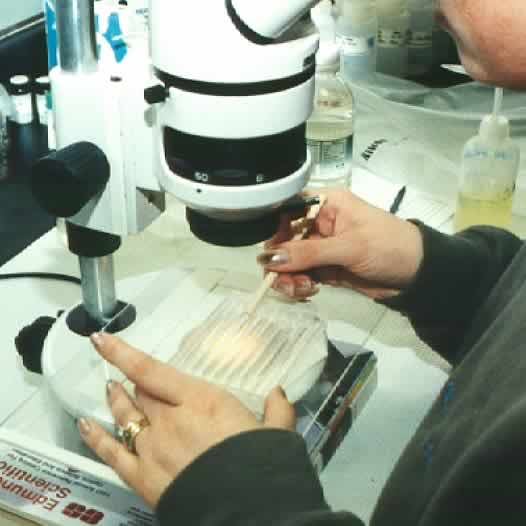
A contagem em microscópio utiliza uma das seguintes lâminas de contagem: Neubauer (h=0,1mm, A=0,0625mm^2), Fuchs-Rosenthal (h=0,2mm, A=0,0625mm^2) e SedgwickRafter (vol=1 ml). Os microrganismos devem ser previamente corados e contados no aumento 1.000x, em microscópio de epifluorescência (foto).

Para a contagem do micro e mesozooplâncton, cujas dimensões estão acima dos 20 um, normalmente é usada a cubeta de Sedgwick-Rafter, de vidro, sem retículo, que possibilita uma melhor resolução óptica. Também pode ser usada a cubeta de plástico, com retículo, que é mais prática para demarcação das transsecções de contagem. Essas cubetas são ideais para a contagem de microzooplâncton: protozoários de grande porte, rotíferos e nauplius.
Determinação da Biomassa de Zooplâncton
A determinação da biomassa de organismos planctônicos é fundamental para conhecer a estrutura dessa comunidade. Há dois métodos para avaliar a biomassa de zooplâncton: o gravimétrico (pesagem de amostras) e o alométrico (uso de equações que relacionam as dimensões lineares dos organismos e seu peso).